1.细胞治疗定义及分类
细胞治疗一般是指将正常的或某些具有特定功能的细胞采用生物工程方法获取和(或)通过体外扩增、特殊培养等处理后,使这些细胞具有增强免疫、杀死病原体和肿瘤细胞、促进组织器官再生和机体康复等治疗功效,然后将这些细胞移植或输入到患者体内,新输入细胞替代受损或患病的细胞或刺激身体的免疫反应或再生的治疗,通常使用的是干细胞与免疫细胞。
类别
|
简介
|
细分类别
|
适应症
|
干细胞治疗
|
帮助受到高剂量化疗或放疗损伤的患者恢复自身造血干细胞的方式
|
干细胞移植
|
·白血病
·淋巴瘤
|
过继细胞转移疗法
|
收集并使用患者自身的免疫细胞来治疗癌症的方式
|
CAR-T
|
·儿童急性淋巴细胞白血病
·成人晚期淋巴瘤
|
TILs
|
·黑色素瘤
·宫颈癌
|
||
TCR
|
·黑色素瘤
·肉瘤
|
||
NK/NKT
|
·复发性或难治性非霍奇金淋巴瘤
·慢性淋巴细胞性白血病
|
||
其他
|
-
|
-
|
-
|
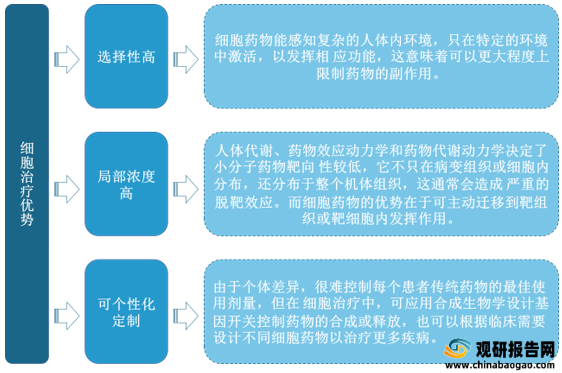
2.细胞治疗优势
细胞治疗具有选择性高、局部浓度高、可个性化定制三大优势。截至2021年4月,全球共有2073种细胞治方案用于临床(研究),较2020年增长38%。目前,CAR-T细胞疗法主导细胞治疗的应用。
3.产业链
根据观研报告网发布的《 2021年中国细胞治疗行业投资分析报告-市场现状与发展动向研究 》显示,随着医药外包服务一体化兴起、国产CAR-T疗法获批在即、我国细胞治疗开发试验数量增加,细胞治疗产业链具有高成长性。
(1)细胞治疗行业产业链上游
我国细胞治疗产业链处于探索状态。目前我国细胞治疗行业产业链上游为细胞治疗的开发、制备及应用环节。
环节
|
简介
|
参与主体
|
|||
研究者
|
药企
|
外包
|
|||
开发
|
-
|
√
|
√
|
√
|
|
制备
|
细跑的分离与活化
|
从患者〔或同种异体的供体)收集外周血单核细胞.随后需要将细胞与其他单核细胞分离
|
|
√
|
√
|
细胞工程(基因改造)
|
细胞进行基因改造,免疫细胞较难转染,可能需要借助病毒或非病毒基因编辑解决方案,并运用转染试剂、慢病毒转导、电穿孔和基因编辑工具等
|
√
|
√
|
√
|
|
细胞培养与洗涤
|
自体细胞与同种异体细胞在分离后均需保证细胞健康,培养基和试剂有助于最大限度地降低研究中的污染和变异风险
|
|
√
|
√
|
|
封装及完成
|
细胞清洗、填充、整理和运输是细胞治疗工作流程的关键步骤,灌装完成后,产品需贴上标签并分发到临床现场或临时存储位置,直到患者准备好给药
|
√
|
√
|
√
|
|
表征与放行测试
|
典型所需的安全检测包括无菌、支原体、内毒素和外源病毒检测
|
|
√
|
√
|
|
应用
|
-
|
√
|
√
|
√
|
|
(2)细胞治疗行业产业链中游
我国细胞治疗行业产业链中游为细胞治疗的临床试验(诊疗)开展环节。为保证安全性,同时鼓励医学研究者以较低成本发展技术,我国采用“双轨制”对细胞治疗产品进行审批。双轨制允许医疗机构在经伦理委员会批准后免费开展细胞治疗临床试验,作为诊疗手段,在政策监管趋严的背景下行业将更加规范发展,但目前仍存在医院与企业利益关联.强制收费及安全性问题。

我国细胞治疗行业产业链下游为受试/受诊环节。以细胞治疗技术形式所申报的项目由NHC监管。和常规NMPA监管不同,细胞治疗技术的开发程序由发起者个人申请、由医院伦理委员会审核通过后开展临床试验,并作为对患者的诊疗手段。整个过程不向患者收取费用。
二、细胞治疗行业市场环境
1.政策驱动
得益于政府相关政策持续支持,干细胞治疗、CAR-T疗法及TCR-T疗法的临床研究与成果转化不断拓展,我国细胞治疗行业大力发展。不同时期的政策侧重点也有所不同,主要可分为三个阶段:上世纪90年代至2008年,政策开始大力支持细胞治疗研究,监管较为宽松;2009年~2012年,细胞治疗政策上强调安全,政策导向以稳妥为主;2015年至今,包括干细胞和免疫细胞在内的细胞治疗发展总体上进入快车道,政策上大力促进。
时间
|
政策名称
|
制定部门
|
主要内容
|
2003.03
|
《人体细胞治疗研究和制剂质量控制技术指导原则》
|
国家食品药品监督管理局
|
每个方案的整个操作过程和最终制品必须制定并严格执行标准操作程序,以确保体细胞治疗的安全、有效。
|
2009.03
|
《医疗技术临床应用管理办法》《首批允许临床应用的第三类医疗技术目录》
|
卫生部
|
免疫细胞治疗技术纳入可以进入临床研究和临床应用的第三类医疗技术;首次应用于临床前必须经过卫生部组织的安全性、有效性临床试验研究、论证及伦理审査;实行第三方技术审核制度,取得卫生行政部门批文的医疗机构在办理了医疗技术等级后方可开展第三类医疗技术临床应用。
|
2009.06
|
《自体免疫细胞(T细胞、NK细胞)治疗技术管理规范(征求意见稿)》
|
卫生部
|
在医疗机构、医护人员、细胞制备技术、细胞制剂质量控制等方面规定了一系列具体的要求。
|
2015.07
|
《国家卫生计生委关于取消第三类医疗技术临床应用准入审批有关工作的通知》
|
卫计委
|
取消第三类医疗技术临床准入审批,免疫细胞治疗技术列为“临床研究”范
畴。
|
2016.12
|
《细胞制品研究与评价技术指导原则(征求意见稿)》
|
CFDA
|
免疫细胞治疗作为药品进行管理,按照药品的管理规范,包括药学研究、药理毒理研究、临床研究等阶段。
|
2017.01
|
《生物制品注册分类及申报资料要求(试行)》《药品注册管理办法(修订稿)》
|
CFDA
|
细胞治疗类产品规定按治疗用生物制品对应类别进行申报。
|
2017.05
|
《“十三五”健康产业科技创新专项规划》
|
科技部、发改委、卫计委等
|
转化中明确将干细胞与再生医学、肿瘤免疫细胞治疗、CAR-T细胞治疗
等新型诊疗服务列为发展的重点任务,还明确要求加快干细胞与再生医学的临床应用。
|
2018.01
|
《知识产权重点支持产业目录(2018年本)》
|
国家知识产权局
|
将干细胞与再生医学、免疫治疗、细胞治疗等明确列为国家重点发展和亟需知识产权支持的重点产业之一。
|
2018.06
|
《CAR-T细胞治疗产品质量控制检测研究及非临床中国食品药品检定研究考虑要点》
|
中国食品药品检定研究院
|
以CAR-T细胞产品的生产工艺及产品特性为主线,对CAR-T细胞治疗产品的适用范围、原材料和辅料的选择及质量控制等多方面进行了规定。
|
2018.09
|
《嵌合抗原受体修饰T细胞(CAR-T细胞)制剂制备质量管理规范》
|
中国医药生物技术协会
|
适用于CAR-T细胞制剂制备的所有阶段
|
2019.02
|
《生物医药新技术临床应用管理条例(征求意见稿)》
|
卫健委
|
生物医学新技术临床研究实行分级管理。
|
2020.01
|
《加强“从0到1”基础研究工作方案》
|
科技部
|
重大专项和重点研发计划中突出支持基础研究重点领域原创方向。
|
2020.07
|
《免疫细胞治疗产品临床试验技术指导原则(征求意见稿)》
|
国家药品监督管理局
|
按照药品管理相关法规进行研发和注册申报的细胞免疫治疗产品,旨在为该类产品开展临床试验的总体规划、设计、实施和试验数据分析等方面提供必要的技术指导。
|
2020.09
|
《关于推动我国细胞产业高质量发展的提案》
|
科技部
|
适用于按照药品管理相关法规进行研发和注册申报的免疫细胞治疗产品。
|
2020.09
|
《免疫细胞治疗产品药学研究与评价技术指导原则(征求意见稿)》
|
国家药品监督管理局
|
干细胞临床研究项目的辅导和指导,共同推进细胞产业发展。
|
2021.01
|
《医疗机构管理嵌合抗原受体T细胞治疗产品临床应用的规范》
|
中国医药生物技术协会
|
适用于医疗机构对嵌合抗原受体T细胞(CAR-T细胞)治疗上市产品临床应用的管理。
|
2.需求驱动
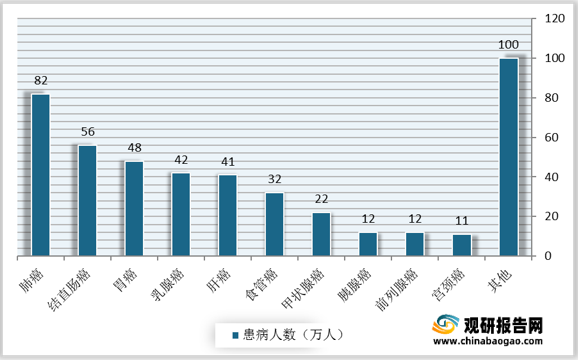
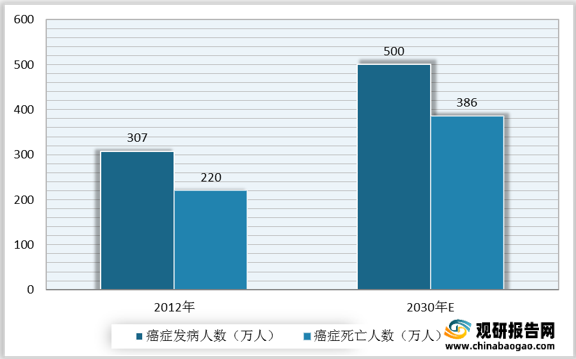
肿瘤是人类疾病第一大杀手。受不良生活习惯及环境污染影响,我国肿瘤患者增多。数据显示,2020年,我国肿瘤患者人数共458万人,其中肺癌、结直肠癌、胃癌人数达82万人、56万人、48万人。
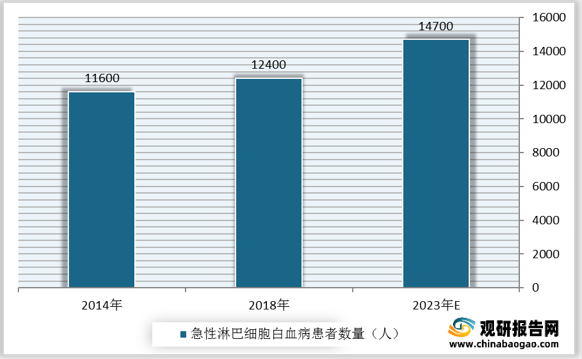
观研报告网发布的资料显示,我国急性淋巴细胞白血病患者数量由2014年的11600人增长至2018年的12400万人,预计2023年将达14700人。
1.细分市场现状
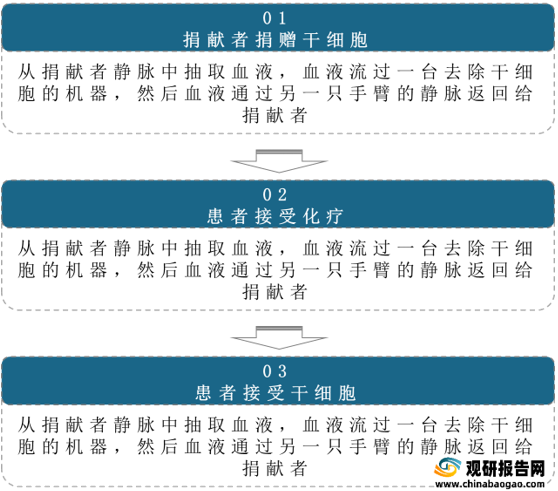
(1)干细胞治疗
干细胞是能自我更新、高度增殖的一类细胞,可以进一步分化成为各种不同的组织细胞。骨髓移植(BMT)和外周血干细胞移植(PBSCT)是常见的干细胞疗法,用以恢复被高剂量化学疗法和/或放射疗法破坏的干细胞。BMT和PBSCT治疗后,患者可接受非常高剂量的化学疗法和(或)放射疗法。
目前海外已批准10余种干细胞产品,我国政府也积极推进将加速干细胞临床应用及产品转化进程,现累计已有11款干细胞产品获得临床批件,成都蓉生静注巨细胞病毒人免疫球蛋白已进入Ⅲ期临床进展最快。
药物名称
|
适应症
|
进展
|
静注巨细胞病毒人免疫球蛋白(pH4)
|
异基因造血干细胞移植后巨细胞病毒(CMV)感染
|
临床II期
|
人脐带间充质干细胞注射液
|
膝骨关节炎
|
临床II期
|
冻干重组人角质细胞生长因子
|
用于治疗血液肿瘤造血干细胞移植患者严重口腔黏膜炎
|
临床I/II期
|
聚乙二醇化重组人粒细胞刺激因子注射液
|
降低以发热性中性粒细胞减少症为表现的感染发生率
|
临床I期
|
人脐带间充质干细胞注射液
|
治疗激素治疗失败的急性移植物抗宿主病
|
临床I/II期
|
注射用间充质干细胞(脐带)
|
难治性急性移植物抗宿主病(aGvHD)
|
临床I期
|
静注巨细胞病毒人免疫球蛋白
|
异基因造血干细胞移植后巨细胞病毒(CMV)感染
|
临床III期
|
骨髓原始间充质干细胞
|
恶性血液病、移植物抗宿主病
|
临床II期
|
间充质干细胞心梗注射液
|
急性心梗恢复期心功能不全的患者
|
临床I期
|
冻干重组人角质细胞生长因子
|
用于治疗血液肿瘤造血干细胞移植患者严重口腔黏膜炎
|
临床I期
|
骨髓原始间充质干细胞
|
恶性血液病、移植物抗宿主病
|
临床II期
|
人胎盘间充质干细胞凝胶
|
糖尿病足溃疡
|
临床I期
|
(2)CAR-T疗法
CAR-T疗法是在工程化受体的引导下,识别并杀死表面带有抗原的癌细胞的疗法,目前全球获FDA批准上市的CAR-T产品有5款,其中2021年新获批2款产品。我国尚未有CAR-T产品获批上市,进展最快的两款产品已申报上市,对标海外产品的成长轨迹,前景广阔。
产品名称
|
企业名称
|
时间
|
适应症
|
靶点
|
Kymriah
|
诺华
|
2017年
|
ALL
|
CD19
|
Yescarta
|
吉利德
|
2017年
|
LBCL
|
CD19
|
Tecartus
|
Kite
|
2020年
|
MCL
|
CD19
|
Breyanzi
|
BMS
|
2021年
|
DLBCL
|
CD19
|
Abecma
|
BMS
|
2021年
|
DLBCL
|
BCMA
|
产品名称
|
企业名称
|
适应症
|
靶点
|
进展
|
瑞基仑赛
|
药明巨诺
|
B细胞淋巴瘤等2项
|
CD19
|
NDA(中国)
|
阿基伦赛
|
复星凯特
|
DLBCL等3项
|
CD19
|
NDA(中国)
|
西达基奥仑赛
|
传奇生物
|
R/R MM
|
BCMA
|
BLA(美国)
|
(3)TCR-T疗法
TCR-T在实体瘤疗效较好,但因为毒性出现停滞,目前已从最开始的基础免疫研究走进临床应用,在部分实体瘤中疗效较好,逐渐往高效、低毒及可操控的通用型方向发展。我国目前还没有TCR-T疗法获批上市。
时间
|
具体情况
|
1999年
|
1999年开始,关于TCR-T疗法的研究报道开始出现。Clay等在研究黑色素瘤的治疗方法时发现TCR基因转导至患者外周血淋巴细胞可在体外产生具有抗肿瘤反应性的细胞毒性T淋巴细胞。
|
2001年
|
Kessels等在小鼠模型中将特异性TCR导入外周T细胞,观察到TCR基因重定向的T细胞在小鼠体内扩增,并有效地归巢于效应位点,可快速诱导肿瘤特异性免疫。
|
2006年
|
研究者Morgan Richard等对17名黑色素癌症患者使用表达特异性针对黑色素瘤细胞分化抗原的TCR改造的T细胞回输,其中2名患者黑色素瘤病变消退,TCR-T疗法临床研究开始发展。
|
2009年
|
Johnson等对比过往实验结果显示了TCR更高的亲和力,在治疗黑色素瘤患者过程中,部分患者出现正常黑色素细胞的破坏,表达高反应性TCR的T细胞介导人类癌症消退的同时靶向体内其他含有同源抗原的细胞,出现肿瘤外毒性。
|
2018年
|
全球已完成TCR-T细胞免疫治疗临床试验31项,主要针对黑色素瘤、食道癌、骨髓瘤、滑膜细胞肉瘤等。
|
2021年
|
在部分实体瘤中疗效较好,逐渐往高效、低毒及可操控的通用型方向发展。
|
2.市场主要参与者
化疗开启了肿瘤用药治疗的征程,科学的不断进步加速了靶点的发现及临床验证,分子分型的临床应用使得医药行业进入靶向治疗时代,随着靶向治疗的不断发展,临床痛点、未满足临床需求和疾病的复发驱动了同靶点药物的不断迭代。创新技术的出现,使得疾病治疗方案更加呈现多样性,随着抗体偶联技术、PROTAC技术、细胞治疗技术、RNA技术的不断涌现,我国医药行业正拥抱创新技术时代的到来。创新技术的迭代背后更加体现的是企业的顶层设计,现阶段,我国细胞治疗行业代表企业包括复星凯特、药明巨诺、传奇生物等。
(1)复星凯特发展情况
复星凯特生物科技有限公司为上海复星医药集团与美国KitePharma(吉利德科学旗下公司)的合营企业,致力于肿瘤免疫细胞治疗产品的研发和产业化规范化发展。成为免疫细胞治疗领域的创新型规范化标杆企业,造福中国患者。6月 22 日,根据国家药监局(NMPA)最新公示,复星凯特CD19 CAR-T细胞治疗产品益基利仑赛注射液(又称阿基仑赛,代号:FKC876)已正式获批用于治疗二线或以上系统性治疗后复发或难治性大B细胞淋巴瘤成人患者。
产品
|
具体情况
|
Yescarta(Axi-Cel)
|
Yescarta(Axi-Cel)是全球首个获得FDA批准上市用于复发或难治性侵袭性大B细胞淋巴瘤(r/rLBCL)的CD19靶点CAR-T细胞疗法。ZUMA-12临床研究结果显示,截至2020年8月25日,32例高危LBCL患者接受次输注Axi-Cel后,27例疗效可评估患者的ORR达85%,CR达74%。安全性方面,CRS(≥3)=9%,NE(≥3)=25%。
|
Tecartus
|
2020年7月24日,FDA加速批准CAR-T细胞疗法Tecartus上市,用于治疗复发/难治性套细胞淋巴瘤(MCL)成人患者。ZUMA-2关键性临床试验中87%的患者对Tecartus的单次输注产生应答,包括62%达到完全缓解(CR)的患者。所有产生应答的患者随访时间均超过6个月。安全性方面,CRS(≥3)=18%,NE(≥3)=37%。
|
Tecartus成为全球首个并且是唯一一个获批治疗MCL的CAR-T细胞治疗产品。Kite公司成为首个拥有多款获批CAR-T产品的公司。
|
(2)药明巨诺
药明巨诺是一家领先的细胞免疫治疗公司,拥有一个集成平台,专注于开发、制造和商业化血液肿瘤和实体瘤的突破性细胞免疫疗法。公司愿景是为中国市场开发创新的细胞疗法,以改变中国患者的癌症治疗方式。该公司已经建立了一个全面和分化的细胞治疗管道,涵盖血液肿瘤和实体瘤。
目标项目
|
合作类型
|
商业化合作详述
|
TCR-T
|
并购
|
2020年7月20日,公司宣布完成了对Syracuse Biopharma的收购,并获得Eureka Therapeutics(优瑞科)专有的针对实体肿瘤的ARTEMIS antibody TCR技术在中国及东南亚国家的授权许可。
|
CAR-T
|
合作开发
|
2020年8月10日,公司宣布与Lyell Immunopharma公司达成开发和商业化协议,在中国和东盟国家推进采用T细胞疗法治疗肝细胞癌。
|
(3)传奇生物
传奇生物由金斯瑞生物科技成立于2014年,是一家专注于血液瘤和实体瘤细胞治疗的生物制药公司,于2021年6月5日在纳斯达克上市,成为国内第一家CAR-T细胞疗法上市的公司。核心产品LCAR-B38M(Cilta-Cel)是靶向BCMA的
CAR-T疗法。BCMA在骨髓瘤细胞和浆细胞上高度表达。Cilta-Cel结构不同于其他同类产品:公司从骆驼中分离出针对BCMA的单域抗体,利用双抗的特质,将两个BCMA结合结构域VHH1和VHH2与4-1BB蛋白(也称为CD137)的T细胞共刺激结构域和CD3 zeta链连接,以形成CAR结构。所得的细胞疗法具有两个抗原结合结构域,其提供与肿瘤抗原的两个接触点,更加紧密和准确地结合靶点,增加了亲和力。
产品
|
试验
|
适应症
|
N
|
有效性
|
安全性
|
cilta-ce
|
CARTITUDE-1,开放式多中心1b/2期试验
|
r/rMM1
|
97
|
ORR=97.9%
sCR=80.4%
mPFS=22.8m
OS(18m)=80.9%
|
CRS(≥3)=4.0%
NE(≥3)=9.3%
|
cilta-cel
|
CARTITUDE-2多队列进行中2期试验
|
MM2
|
我们预计总患者数160人,A队列入组20人
|
ORR=95%
CR/sCR=75%
|
CRS(≥3)=10%
NE=20%
NE(≥3)=0%
|
四、细胞治疗行业发展前景
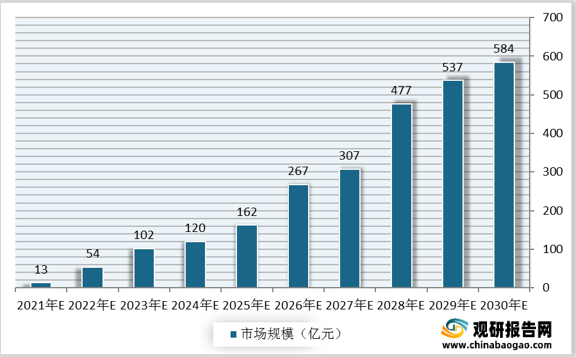
产品研发、市场和商业化途径对未来的细胞治疗商业化具有重大的影响。至2021年6月,我国有三款国产CAR-T产品处于上市申请阶段,其中两款在国内申请(药明巨诺瑞基伦赛、复星凯特阿基伦赛),另外一款在美国申请(传奇生物西达基奥仑赛)。国产产品的顺利上市将推动我国细胞治疗市场规模上升。预计我国我国细胞治疗市场规模将由2021年的13亿元增长至2030年的584亿元。
行业分析报告是决策者了解行业信息、掌握行业现状、判断行业趋势的重要参考依据。随着国内外经济形势调整,未来我国各行业的发展都将进入新阶段,决策和判断也需要更加谨慎。在信息时代中谁掌握更多的行业信息,谁将在未来竞争和发展中处于更有利的位置。


【版权提示】观研报告网倡导尊重与保护知识产权。未经许可,任何人不得复制、转载、或以其他方式使用本网站的内容。如发现本站文章存在版权问题,烦请提供版权疑问、身份证明、版权证明、联系方式等发邮件至kf@chinabaogao.com,我们将及时沟通与处理。